流式实验样品制备实验指南

流式实验,即流式细胞术(Flow Cytometry),是非常重要的一种生物分析技术,常用于细胞免疫表型分析、细胞分型、细胞功能评估等实验场景。流式实验主要包括前期实验设计、样品制备、样品染色和样品分析四个步骤,而其中样品制备是流式实验非常重要的步骤之一,影响了实验结果的准确性。
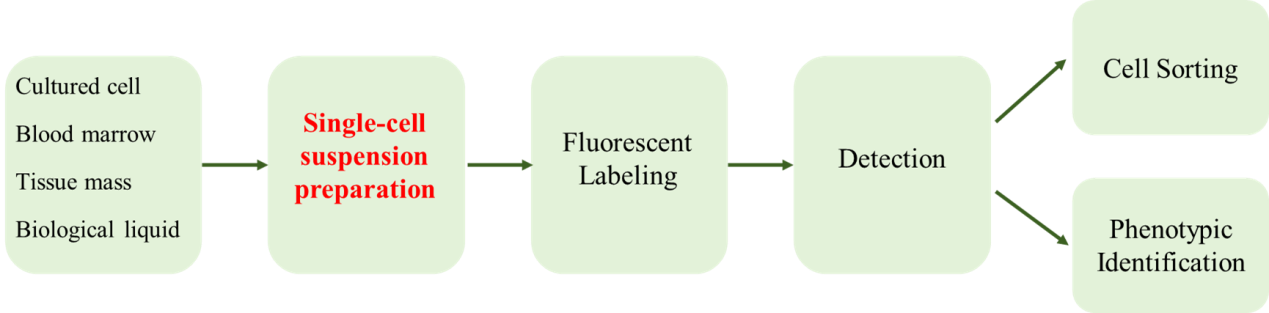
图1 流式细胞术主要实验流程
单细胞悬液是流式细胞术对细胞进行分析检测的前提条件。制备过程中,它既要求组织分散成为单个细胞,又要维持细胞的固有属性及生物学特性。外周血细胞或悬浮生长的细胞最适合流式分析,其他样本类型在制备过程中可用的方案较多,本文总结了4种流式样品制备成单细胞样品的实验步骤,以作参考。
一、外周全血
流式实验中常采用EDTA或肝素钠抗凝的外周全血。处理方法:
1、用溶血素裂解红细胞;
2、用Ficoll或Percoll从外周全血中分离PBMCs,从对应密度层获得目的细胞进行清洗和染色。


表2:裂红和淋巴细胞分离液方法对比
1、外周全血裂红实验方案
1.1裂红洗涤方案
1)将适量的表面抗体加至抗凝全血中,室温孵育15分钟;
2)加入1×红细胞裂解液(例如,R478427),室温避光孵育10分钟,300-400 xg离心5分钟,弃上清;
3)加入PBS/流式细胞染色缓冲液(例如,T494526),混匀;
4)按上述条件再次离心并将沉淀分散在PBS/流式细胞染色缓冲液中;
5)3小时内上机检测。若不能立刻上机,用500 ul 4%多聚甲醛(例如,P395744)重悬细胞,4℃避光保存,24 h内上机分析。
1.2裂红洗涤方案
1)将适量的表面抗体加至抗凝全血中,室温孵育15分钟;
2)加入1×红细胞裂解液,室温避光孵育10分钟;
3)混匀,上机检测。
2、外周血单个核细胞分离
1)用无菌稀释液将血样稀释2-4倍;
2)在50 mL锥底离心管中先加入15-20 mL分离液,然后缓慢加入20-30 mL经稀释的全血或组织细胞悬液至分离液液面之上;
3)室温400 xg离心15-30分钟,保证转子速度平稳下降;
4)将离心管小心地从离心机中取出,缓缓地吸去最上层,避免接触单个核细胞层;
5)将单个核细胞层缓慢转移到另一只50 mL锥底离心管中;
6)加入无菌洗涤液并混匀后,室温300 xg离心10分钟,小心弃掉上清;
7)为去除残余血小板,可将细胞重悬于30-50 mL无菌洗涤液中,室温200 xg离心10-15分钟,弃上清;
8)可选择性重复步骤7,以去除绝大部分血小板;
9)用缓冲液或培养基重悬细胞,进行检测、培养等后续操作。
注:骨髓样本的实验步骤同外周全血。
3、外周血中血小板富集的血浆制备
1)取适量体积血液于25℃下300 xg离心10分钟;
2)将离心后获得的血浆层,于25℃ 1600 xg离心10分钟;
3)弃上清,沉淀重悬于Tyrode’s缓冲液或含EDTA的缓冲液中,进行下游实验。
二、培养细胞
1、收集处于对数生长期的细胞。
2、PBS清洗细胞(例如,T494526)。
3、加入胰蛋白酶(例如,T105532)或Accutase消化液解离细胞,筛网过滤。
4、1500 rpm离心10分钟,弃上清。
5、用PBS缓冲液(例如,T494526)重悬细胞沉淀,收集细胞悬液,进行细胞计数和活力检测。随后可按照荧光抗体染色的操作,进行后续实验。
三、组织
1、淋巴组织
1)将脾、胸腺或淋巴结采集到含缓冲液或培养基的细胞培养皿中,用注射器活塞在细胞筛网上研磨;
2)使用PBS(例如,T494526)冲洗细胞滤网,滤掉细胞团块和碎片;
3)4˚C 300-400 xg离心5分钟,弃上清;
4)用适当体积的缓冲液重悬细胞,进行细胞计数和活性检测,并调整细胞浓度至107个/mL,进行下游实验。
2、非淋巴组织
1)使用手术剪或解剖刀片将组织切成2-4 mm小块,用合适类型的消化酶,孵育;
2)过细胞筛网,将细胞悬液收集在离心管内;
3)4˚C 300-400 xg离心,5 分钟,弃上清,用PBS重悬细胞(例如,T494526);
4)重复离心,并用流式细胞染色缓冲液重悬细胞,进行细胞计数和活性检测,调整终浓度达到10⁷个/mL。
以酶解法处理实体瘤组织为例:
1、实体瘤单细胞悬液制备。
实体瘤的酶解利用胰蛋白酶破坏细胞间粘附和II型胶原酶消化基质成分,并且DNA酶I(例如,D128591)的加入可以确保倍性仅从完整的细胞群体中确定。酶解法可以单独使用或与机械方法结合使用,建议用于鳞状肿瘤的完全分解。
1)酶混合物制备:将2.5 mg/mL胰蛋白酶(例如,T105532)、0.5 mg/mL II型胶原酶、20 µg/ml DNase I(例如,D128591)添加至离心管中混合,37°C孵育15 分钟;
2)将新鲜的肿瘤组织或机械分解的组织放入酶混合物中,37°C温和搅拌1h;
3)过80 µm金属网筛,加入2ml灭活的FBS终止反应,室温250 xg离心10分钟,弃掉上清;
4)用培养基重悬细胞,并进行细胞计数和活性检测。
2、乙醇固定:
对于已获得的实体瘤单细胞悬液,可以使用乙醇固定以延长保存天数,且不影响核完整性。
1)将2 mL重悬单细胞悬液涡旋,期间滴式加入6 mL冰70%乙醇。
2)加盖置于4°C保存,可保存30 mins-5 days。
3)固定后的细胞可用于部分流式实验。
四、生物液体样本
如肺泡灌洗液、胸腹水、脑脊液
1、收集液体样本,300-400 xg离心5分钟,弃上清,收集细胞沉淀;
2、如细胞沉淀中肉眼可见红细胞,加入适量红细胞裂解液(例如,R478427),根据样本红细胞含量避光孵育2-10分钟,300-400 xg离心5分钟,弃上清,收集细胞沉淀;PBS(例如,T494526)重悬细胞,300-400 xg离心5分钟,弃上清(选做);
3、PBS(例如,T494526)重悬细胞,300-400 xg离心5 分钟,弃上清;
4、将细胞重悬于适当体积的PBS(例如,T494526)或流式细胞染色缓冲液中,进行细胞计数和活性检测,并将终浓度调整为1x107个细胞/ml,进行下游实验。
如需了解更多产品详情,请前往阿拉丁官网查询。
 首页
首页 400-620-6333
400-620-6333
