磁颗粒在细胞器分离中的应用

在生物分析化学中,使用分离细胞器以分析其含量或功能是非常重要的,它是许多生物医学分析的基础。一般情况下,使用机械均质法制备细胞均质液后,会有多种细胞器类型的混合物。然后,利用免疫亲和分离或离心对细胞器进行分馏,通过分馏我们可以获得富集的目标细胞器组分。在此过程中,要求具备细胞器的污染水平较低,相关分析技术灵敏度高,且具备低样品量兼容特性,以及获得特定细胞器类型亚组分的能力。科学家们开发了许多更好的富集技术来满足生物分析化学中的这些需求。在这里,我们重点介绍磁颗粒对细胞器的免疫亲和分离的应用。
图1:细胞内部各细胞器示意图
细胞器的免疫亲和分离是基于抗体与目标细胞器表面发现的抗原或蛋白质之间的相互作用进行的。然而,随着合适抗体数量的不断增加,以及对免疫纯化细胞器功能状态的评估能力的提高,这一格局开始发生变化。关于利用抗体偶联磁颗粒分离细胞器的报道很多,包括突触囊泡、外泌体、叶绿体、线粒体、过氧化物酶体和溶酶体的分离。
突触囊泡
突触囊泡可能是最丰富的囊泡细胞器,由于纯化程度高,其功能和分子组成已经 得到了很好的研究。它们在电子显微镜水平上呈球形,特征横截面直径约为40 nm±4% ~ 9%。突触囊泡可以通过差速离心、基于密度的沉淀和大小分级分离纯化,而如今它们也可以通过结合各种识别突触囊泡蛋白的抗体的磁性颗粒来纯化。Burré等人通过低渗休克从大鼠脑中释放突触囊泡,然后使用蔗糖密度梯度离心纯化。他们还通过使用四种不同类型的磁颗粒进行免疫分离纯化了特定的梯度 组分。结果表明,M-280羊抗鼠珠是效率最高的一组,为后续实验提供了低非特异性结合的纯突触囊泡样品。
液外泌体是细胞外囊泡的一个亚群,直径约为30至100nm。它们由脂质、碳水化合物、蛋白质和核酸组成,可以作为细胞间通讯的一种方式,从起源细胞释放出来,在靶细胞上启动不同的功能。利用靶向外泌体特异性标记物,可以以越来越高的纯度捕获特异性外泌体。该策略对于从培养基补充物中去除共富集的外泌体和分离外泌体亚群也是理想的。考虑到与后续分析的兼容性,基于珠状体的方法是一种用于特异性捕获的通用方法。虽然乳胶珠已被用于特异性捕获,但该方案涉及许多离心步骤,并且在可重复性方面具有挑战性。因此,磁性颗粒的磁分离是一种更好的方法,可以替代乳胶珠进行外泌体捕获,它可以在大小、形态和蛋白质含量方面分离出更均匀的囊泡群。Clayton等人开发了一种快速、通用的外泌体分离技术。该方法使用抗mhc II类抗体包被到更大的固体表面(4.5μm磁性颗粒)进行下游分析。
叶绿体
不同细胞类型的叶绿体结构是不同的。然而,通常很难从特定细胞中分离出叶绿体,因此我们对不同叶绿体结构和功能之间的关系了解不多。Truernit等人开发了一种方法,利用外源黄色荧光蛋白标记来自单个细胞类型的叶绿体表面,然后通过免疫原性方法分离出这些叶绿体。将整个叶片匀浆后,标记的和未标记的叶绿体都被释放出来,标记的叶绿体可以通过包裹有绿色荧光蛋白抗体的磁性颗粒进行分离。他们发现,各种叶绿体转录物的丰度在拟南芥海绵状叶肉细胞、维管细胞和表皮细胞之间存在差异。而且,这种方法基于遗传逻辑,因此也可用于从其他可转化生物中分离细胞器或亚细胞区室。
线粒体
线粒体通过调节细胞的关键功能,在维持细胞的生命和死亡过程中发挥重要作用。因此,线粒体功能障碍可导致多种人类疾病,并可能与癌症、心血管疾病、神经 退行性疾病等有关。开发技术来获取线粒体靶点,以治疗线粒体功能障碍相关疾 病,是人们越来越感兴趣和紧迫的问题。Banik等人报道了一种靶向线粒体的磁性纳米粒子(Mito-magneto),它可以在不需要离心和免疫沉淀的情况下有效地分 离线粒体(图 1)。Mito-magneto是一种基于Fe3O4磁铁矿的磁性纳米粒子,其表面被三苯磷(TPP)阳离子功能化。这种磁性纳米颗粒能够在磁场的影响下分离线粒体,并且获得的线粒体完整、纯净且具有呼吸活性。此外,它还消除了通常与使用离心分离负载纳米颗粒的线粒体相关的伪影。
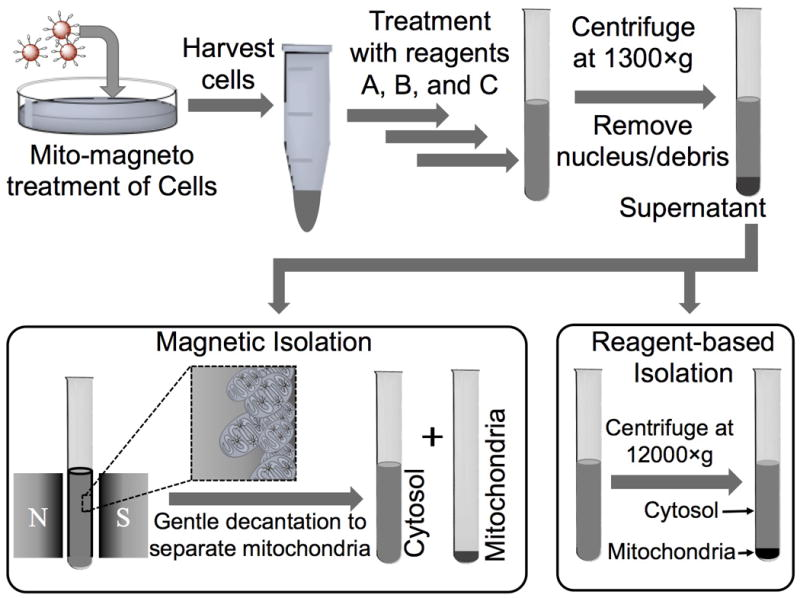
图2:采用磁性颗粒和试剂为基础的线粒体分离程序示意图
过氧化物酶体
产生活性氧的过氧化物酶体可能参与先天生物分子和异种生物的生物转化。为了避免与其他共分离细胞器中发生的生物转化混淆,分离出污染物较少的功能性过氧化物酶体来研究这些细胞器中发生的生物转化是很重要的。Wang等人将针对70 kDa过氧化物酶体膜蛋白的抗体固定在包裹有蛋白a的硅化磁性氧化铁颗粒上,然后,他们从L6大鼠成肌细胞匀浆中磁性捕获过氧化物酶体,随后进行洗涤并通过酶测定分析亚细胞组成。结果表明,过氧化物酶体纯度更高,并保留了其生物活性。
溶酶体
溶酶体是具有消化酶的膜结合细胞器。它们参与各种细胞过程,包括分解多余或破损的细胞部分,摧毁入侵的病毒和细菌,以及细胞凋亡。溶酶体表面有V-
ATPase的表达。基于此,Nylandsted等人在免疫纯化程序中利用抗v-atpase抗体富集溶酶体。磁柱内保留的细胞器本质上是酸性的。蛋白质组学分析结果显示, 富集蛋白的亚细胞定位主要来自溶酶体和部分核内体。此外,只发现了一种线粒体相关蛋白,没有检测到任何高尔基体、质膜和内质网积分膜蛋白,这表明该方法足以纯化溶酶体。
参考文献
1.Šafařík, I., & Šafaříková, M. (2002). Magnetic nanoparticles and biosciences. In nanostructured materials (pp. 1-23). Springer, Vienna. https://link.springer.com/chapter/10.1007/978-3-7091-6740-3_1
2.Burré, J., Zimmermann, H., & Volknandt, W. (2007). Immunoisolation and subfractionation of synaptic vesicle proteins. Analytical biochemistry, 362(2), 172-181. https://doi.org/10.1016/j.ab.2006.12.045
3. Truernit, E., & Hibberd, J. M. (2007). Immunogenic tagging of chloroplasts allows their isolation from defined cell types. The Plant Journal, 50(5), 926-932. https://doi.org/10.1111/j.1365-313X.2007.03113.x
4. Wang, Y., Taylor, T. H., & Arriaga, E. A. (2012). Analysis of the bioactivity of magnetically immunoisolated peroxisomes. Analytical and bioanalytical chemistry, 402(1), 41-49. https://link.springer.com/article/10.1007/s00216-011-5476-3
5.Satori, C. P., Kostal, V., & Arriaga, E. A. (2012). Review recent advances in the analysis of isolated organelles. Analytica chimica acta, 753, 8-18. https://doi.org/10.1016/j.aca.2012.09.041
6.Banik, B., & Dhar, S.(2018). Centrifugation‐Free Magnetic Isolation of Functional Mitochondria Using Paramagnetic Iron Oxide Nanoparticles. Current protocols in cell biology, 76(1), 25-4. https://doi.org/10.1002/cpcb.26
7.Oksvold, M. P., Neurauter, A., & Pedersen, K. W.(2015). Magnetic bead-based isolation of exosomes. In RNA Interference(pp. 465-481). Humana Press, New York, NY. https://link.springer.com/protocol/10.1007/978-1-4939-1538-5_27
8.Tchikov, V., Fritsch, J., Kabelitz, D., & Schütze, S. (2010). Immunomagnetic isolation of subcellular compartments. In Methods in Microbiology (Vol. 37, pp. 21-33). Academic Press. https://doi.org/10.1016/S0580-9517(10)37002-4
 首页
首页 400-620-6333
400-620-6333
